
科目: 来源: 题型:选择题
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| D. | 将含有0.1 mol FeCl3的饱和溶液滴入沸水中,生成的胶体中含胶体粒子的数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | -332kJ | B. | -118kJ | C. | +130kJ•mol-1 | D. | +350kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 澄清透明溶液中可能大量存在:Cu2+、Mg2+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液中可能大量存在:K+、NH4+、Cl-、I- | |
| C. | 加入A1能放出大人量H2的溶液中可能大量存在:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×l0-12的溶液中可能大量存在:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(SO2)=0.25 mol•L-1 | B. | c(O2)=0.12 mol•L-1 | ||
| C. | c(SO2)+c(SO3)=0.15 mol•L-1 | D. | c(SO3)+c(O2)=0.3 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | 现象 | 实验结论 | |
| A | 将SO2气体通入紫色石蕊试液中 | 溶液先变红后褪色 | 二氧化硫具有酸性和漂白性 |
| B | 将小苏打和硫酸应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| D | 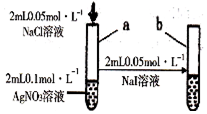 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 17.9mol•L-1 34.7% | B. | 20.4mol•L-1 33.8% | ||
| C. | 17.9mol•L-1 33.8% | D. | 20.4mol•L-1 34.7% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 | |
| B. | 500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 已知热化学方程式:2SO2(g)+O2?(g) 2SO3(g)△H=-Q kJ/mol,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| D. | X(g)+Y(g)?Z(g)△H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com