
科目: 来源: 题型:解答题
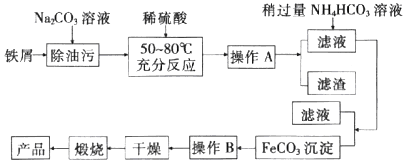
查看答案和解析>>
科目: 来源: 题型:推断题
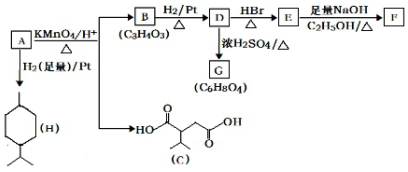
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$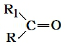 +R2COOH
+R2COOH .
. .
.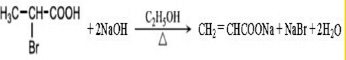 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某反应正、逆反应的活化能分别为EakJ/mol、EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| B. | H2的热值为142.9kJ/g,则有2H2(g)+O2(g)═2H2O (1)△H=-285.8kJ/mol | |
| C. | 将浓度为0.1mol/LHF溶液加水不断稀释过程中,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持减小 | |
| D. | 混合前$\frac{c(C{H}_{3}COOH)}{c(NaOH)}$=2,等体积的混合后溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤 | 解释或实验结论 |
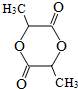
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)该有机物分子中含有羟基、羧 基各1mol,羟基的电子式为 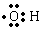 . . |
(4)A的核磁共振氢谱如图: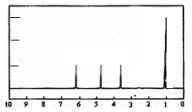 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式 , , | |
查看答案和解析>>
科目: 来源: 题型:解答题
| W | X | Y |
| Z |
 .
.| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI═Z↓+2I2+1H2O |
| ① | 酸性 | H2SeO3+2NaOH=Na2SeO3+2H2O |
| ② | 还原性 | H2SeO3+Cl2+H2O=H2SeO4+2HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D |
| 钢闸门容易被腐蚀 | a、b均为惰性电极,b极反应是:O+4OH--4e-=2H2O | 阴、阳两极生成的气体的物质的量之比是1:1 | 电池工作一段时间 后,乙池溶液的总质量增加 |
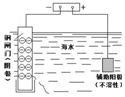 | 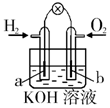 | 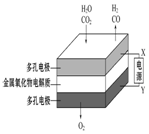 | 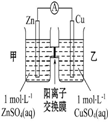 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L C2H4与C3H6混合气体所含有分子数为NA | |
| B. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1mol Na2O2与足量的CO2反应转移的电子数为2NA | |
| D. | 18g NH4+所含的电子数11NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质且能溶于浓硝酸 |
| C | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.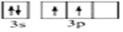 .
.| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6.4gO2和O3的混合气体,含氧原子数为0.4NA | |
| B. | 分子标准状况下,11.2LCCl4中含分子数为0.5NA | |
| C. | 1mol乙酸(忽视挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5 | |
| D. | 常温常压下,7.8gNa2O2含离子数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com