
科目: 来源: 题型:选择题
| A. | 高价铁盐可用于硬水的软化 | |
| B. | 钾、钠、镁等活泼金属着火时.不能用泡沫灭火器灭火 | |
| C. | 生产水泥和玻璃均可用到碳酸钙 | |
| D. | 石英砂可用干生产粗硅 |
查看答案和解析>>
科目: 来源: 题型:选择题
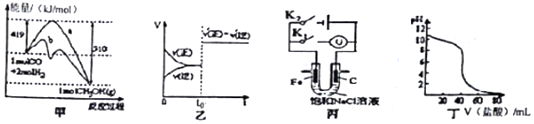
| A. | 图甲表示工业上用CO生成甲醇的反应CO(g)+2H2(g)?CH2OH(g),该反应的△H=-91kJ•mol-1 | |
| B. | 图乙表示已达到平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂 | |
| C. | 图丙中若K1闭合,石墨棒周围溶液pH逐渐升高;若K2闭合,电路中通过0.002NA个电子时,两极理论上共产生0.002mol气体 | |
| D. | 图丁表示盐酸滴加0.1 mol•L-1NaOH溶液的得到的滴定曲线,该实验的指示剂最好选取酚酞 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥均需要用石灰石做原料 | |
| B. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、煤的干馏、海水晒盐、从菜籽中提取菜籽油等过程都是物理变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 不移动 | |
| D. | 可能向正反应方向移动,也可能向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
查看答案和解析>>
科目: 来源: 题型:解答题
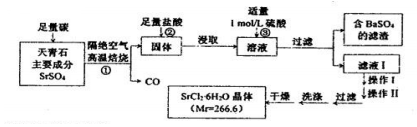
查看答案和解析>>
科目: 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )| A. | 原氨水浓度x=0.01mol•L-1 | |
| B. | m、p两点溶液中由水电离出来的c(OH-):m>p | |
| C. | n点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 若在m点溶液中加少量水,[c(NH3•H2O)•c(H+)]/c(NH4+)不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
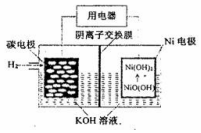
| A. | 放电时,OH-向碳电极迁移 | |
| B. | 放电时,负极反应NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,镍电极与电极的正极相连 | |
| D. | 充电时,碳电极区溶液pH增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
 )和抗癫痫药物
)和抗癫痫药物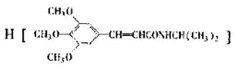 的路线如下(部分反应条件和试剂略去)
的路线如下(部分反应条件和试剂略去)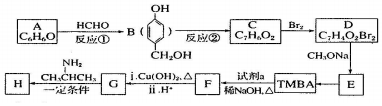
 +H2O(R、R′表示烃基或氢原子)
+H2O(R、R′表示烃基或氢原子)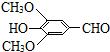 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→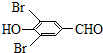 +2HBr.
+2HBr.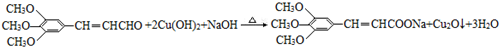 .
.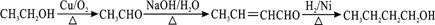 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室效应的排放 | |
| B. | 胶体和溶液的本质区别是胶体具有丁达尔现象 | |
| C. | SiO2既能与氢氧化钠溶液反应又能与氢氟酸反应,SiO2是两性氧化物 | |
| D. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com