
科目: 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:HCO3-、NO3-、Na+、NH4+ | |
| B. | pH=7溶液中:Fe3+、K+、SO42-、NO3- | |
| C. | 加入铝粉能产生H2的溶液:NH4+、K+、CO32-、NO3- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1mol?L-1的溶液中:Na+、K+、SiO32-、AlO2- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S$\stackrel{O_{2}、点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}溶液}{→}$BaSO3 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3 |
查看答案和解析>>
科目: 来源: 题型:推断题
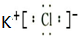 ;
;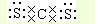 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | Mn | Fe | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| B. | 戊烷有4种同分异构体,它们熔点、沸点各不相同 | |
| C. | 油脂发生皂化反应可以得到高级脂肪酸盐与甘油 | |
| D. | 淀粉和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用盐酸除铁锈:Fe2O3•xH2O+6H+═2Fe3++(3+x)H2O | |
| B. | Mg(HCO3)2溶液与足量的 NaOH 溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | 强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ | |
| D. | 用NaOH 溶液吸收 NO2:2NO2+2OH-═2NO3-+H2O |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
| 成 分 | 质 量(g) | 摩尔质量(g/mol) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
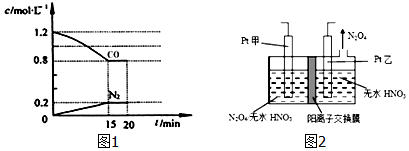
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com