
科目: 来源: 题型:解答题
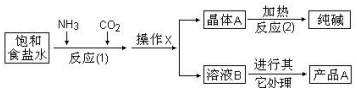
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
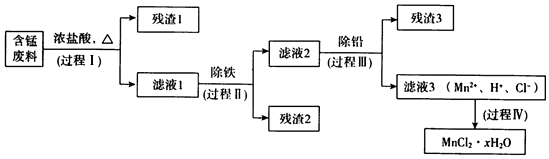
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]•3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4•2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
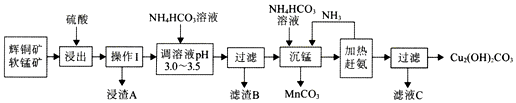
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘易升华是因为分子间的共价键较弱 | |
| B. | 构成单质分子的微粒一定含有化学键 | |
| C. | 离子化合物可能含共价键,共价化合物中可能含离子键 | |
| D. | 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 向盛有少量NaHCO3的试管中滴加草酸溶液有气泡产生 | 酸性:草酸>碳酸 |
| D | 向少量某物质的稀溶液中滴加稀盐酸,产生了能使澄清石灰水变浑浊的气体 | 该物质一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com