
科目: 来源: 题型:选择题
| A. | 常温常压下,23gNO2和N2O4混合气体中含O原子数为NA | |
| B. | 1mol/L Al2(SO4)3溶液中含SO42-个数为3NA,含Al3+个数小于2NA | |
| C. | 在标准状况下,将22.4L SO3溶于水配成1L溶液,所得溶液中含SO42-个数为NA | |
| D. | 将1moL 氯气通入到足量水中,则N(HClO)+N(Cl-)+N(ClO-)═2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.| 离子半径 | 还原性 | 得电子能力 |
| N3-大于Al3+ | O2-小于S2- | 35Cl等于37Cl |
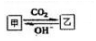
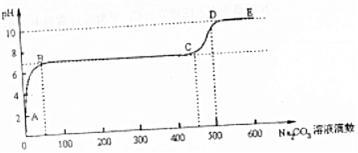
查看答案和解析>>
科目: 来源: 题型:实验题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目: 来源: 题型:实验题
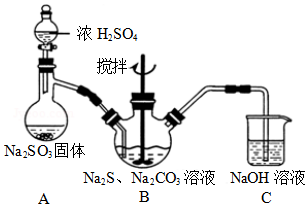
| 实验次数 | 样品溶液体积(mL) | 滴定消耗0.100mol/L碘溶液体积(mL) |
| 1 | 20.00 | 9.80 |
| 2 | 20.00 | 10.70 |
| 3 | 20.00 | 9.90 |
查看答案和解析>>
科目: 来源: 题型:解答题
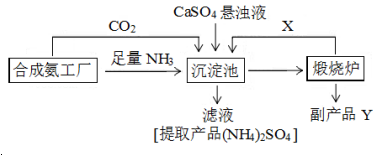
 | 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
| 420℃ | 0.9961 | 0.9972 | 0.9984 |
| 520℃ | 0.9675 | 0.9767 | 0.9852 |
| 620℃ | 0.8520 | 0.8897 | 0.9276 |
查看答案和解析>>
科目: 来源: 题型:解答题
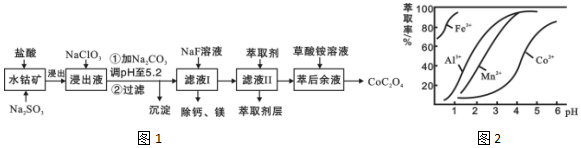
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:实验题
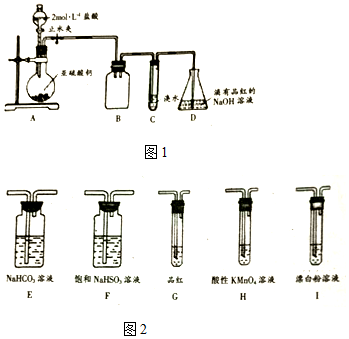
查看答案和解析>>
科目: 来源: 题型:解答题
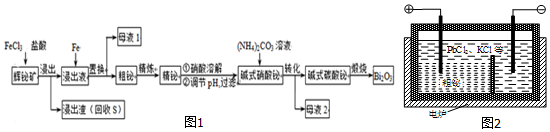
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
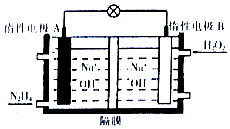 肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
肼(N2H4)是一种高能燃料,在工业生产中用途广泛.查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 甲烷(乙烯) | 溴水 | 洗气 |
| B | 氢氧化钠溶液(氢氧化钙溶液) | 二氧化碳 | 过滤 |
| C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
| D | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com