
科目: 来源: 题型:推断题
 .用电子式表示D2C的形成过程
.用电子式表示D2C的形成过程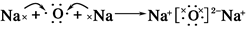 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | A | B | C | D | E | F | G | H |
| 原子半 径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要 化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
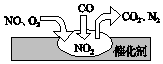 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3:7 | B. | 7:1 | C. | 5:3 | D. | 1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低 | |
| C. | 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| D. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线 |
查看答案和解析>>
科目: 来源: 题型:选择题
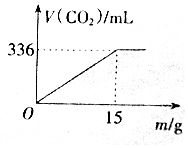 一定质量的铁碳合金在足量的氧气中燃烧,合金质量与生存二氧化碳体积(已换算为标准状况)关系如图所示,则此铁碳合金是( )
一定质量的铁碳合金在足量的氧气中燃烧,合金质量与生存二氧化碳体积(已换算为标准状况)关系如图所示,则此铁碳合金是( )| A. | 低碳钢 | B. | 中碳钢 | C. | 高碳钢 | D. | 合金钢 |
查看答案和解析>>
科目: 来源: 题型:选择题
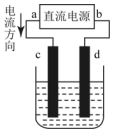
| A. | c极发生还原反应 | B. | 每生成6.4gCu,转移电子0.2mol | ||
| C. | 阳极反应式:Cu2++2e→Cu | D. | 在溶液中电子由d流向c |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
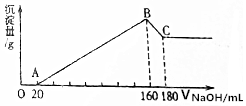 将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.
将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe与A1的物质的量之比为1:1 | |
| B. | 混合气体中 NO为0.03mol,N2O0.12mol | |
| C. | 原HNO3溶液的浓度C=4.6mol/L | |
| D. | 反应中被还原的HNO3为0.18 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com