
科目: 来源: 题型:实验题
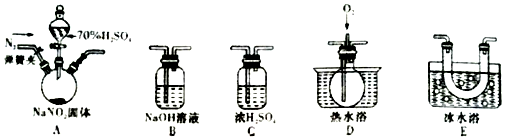
查看答案和解析>>
科目: 来源: 题型:解答题
| 实 验 Ⅰ | 操作 | 现象 |
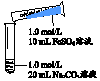 | 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
| 实验Ⅱ | 操作 | 现象 |
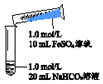 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
| 实验Ⅱ | 操作 | 现象 |
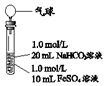 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a能将e从其氧化物中置换出来,因此非金属性a>e | |
| B. | b元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| C. | 工业上不用电解氯化物的方法制备单质d是由于其氯化物的熔点高 | |
| D. | 相同质量的c和d单质分别与足量稀盐酸反应,前者生成的氢气多 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘是人体内必须的微量元素,所以富含高碘酸的食物适合于所有人群 | |
| B. | 化石燃料不完全燃烧会产生CO造成污染,完全燃烧不会造成大气污染 | |
| C. | 利用铁比铜金属性强的性质,常用FeCl3溶液腐蚀Cu来刻制印刷电路板 | |
| D. | 中国古代利用明矾溶液清除铜镜表面的铜镑,是利用了明矾溶液的酸性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.12g | B. | 4.28g | C. | 4.68g | D. | 5.08g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H6和C3H8 | B. | C5H10和C6H6 | C. | C2H6O和C2H4O2 | D. | C3H6和C3H8O2 |
查看答案和解析>>
科目: 来源: 题型:实验题
 为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验 编号 | 温度(K) | 盐酸浓度/ (mol•L-1) | 醋酸浓度/ (mol•L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究温度 对镁与盐酸反应速率的影响; II.实验a和c是探究浓度 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d | -- | -- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 镁和铁 | B. | 钠和铁 | C. | 锌和铜 | D. | 铁和铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com