
科目: 来源: 题型:选择题
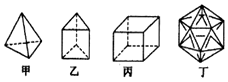
| A. | 1mol甲分子内含有10mol共价键 | B. | 乙分子的一氯取代产物只有一种 | ||
| C. | 丙分子的二氯取代产物只有两种 | D. | 丁分子显然是不可能合成的 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑥ | C. | ②③④⑤ | D. | ②⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯的电子式是 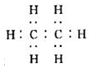 | B. | 乙烯的结构式为CH2CH2 | ||
| C. | 乙烯分子中所有原子共平面 | D. | 5.6L乙烯气体中含有1mo1C-H键 |
查看答案和解析>>
科目: 来源: 题型:选择题
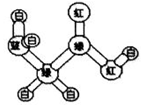 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醛 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纤维素在人体内可以水解成葡萄糖 | |
| B. | 组成蛋白质的元素中,一定含有碳、氢、氧、氮 | |
| C. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素 | |
| D. | 天然蛋白质水解后的最终产物是a-氨基酸 |
查看答案和解析>>
科目: 来源: 题型:推断题
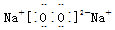 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | Na+不断向“水”电池的负极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水防止食品变质 | |
| C. | 采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体 | |
| D. | 中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com