
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
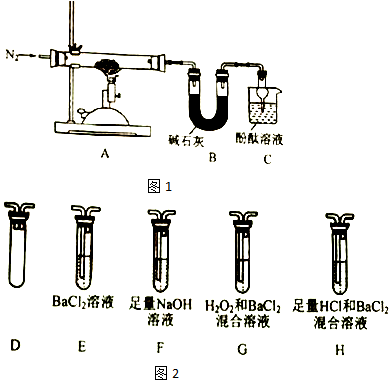
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①>②>③=④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{9a}{700}$ | B. | $\frac{3a}{700}$ | ||
| C. | 0 | D. | 缺少条件,无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com