
科目: 来源: 题型:解答题
| 阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目: 来源: 题型:实验题
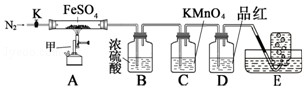
| 实验 | 滴定管 开始读数 | 滴定 终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
查看答案和解析>>
科目: 来源: 题型:解答题
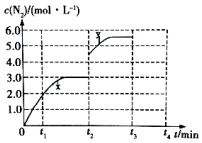 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
查看答案和解析>>
科目: 来源: 题型:实验题
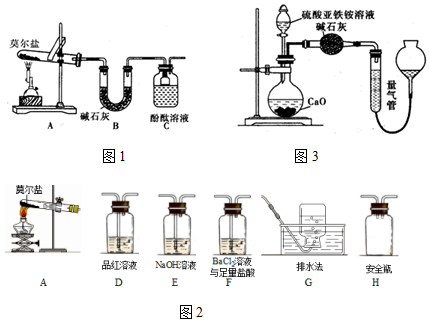
查看答案和解析>>
科目: 来源: 题型:实验题
 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃600℃1000℃2000℃ |
| 主要成分 | Fe2O3 Fe3O4 FeO Fe |
查看答案和解析>>
科目: 来源: 题型:实验题
 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
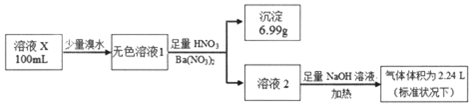
| A. | 溶液X肯定只存在NH4+、SO42- | |
| B. | 溶液X一定不含有Ba2+、Fe3+,可能含有I- | |
| C. | 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液 | |
| D. | 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧 |
查看答案和解析>>
科目: 来源: 题型:实验题
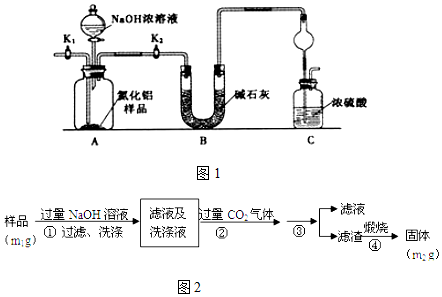
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com