
科目: 来源: 题型:选择题
| A. | NH4Cl受热易分解,可用于实验室制氨气 | |
| B. | 液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 | |
| C. | NO2气体有毒,且可以和水反应,实验室多余的NO2气体用水吸收即可 | |
| D. | N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气 |
查看答案和解析>>
科目: 来源: 题型:解答题
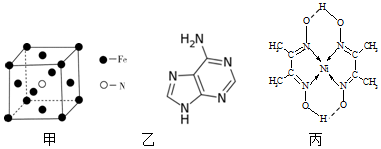
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 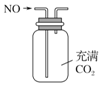 用图所示装置(正放)可收集NO气体 | |
| B. | 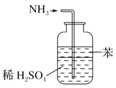 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 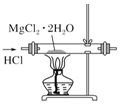 用装置制取无水MgCl2 | |
| D. | 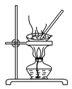 用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2+ | B. | NH${\;}_{4}^{+}$ | C. | HCO${\;}_{3}^{-}$ | D. | OH- |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
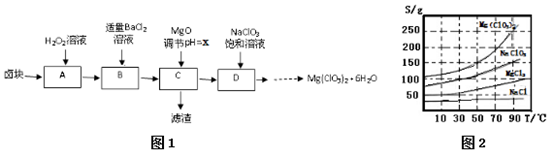
| 化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题

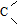 →-N=
→-N=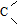 ;
;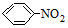 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$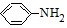 (易被氧化).请回答:
(易被氧化).请回答: ;
;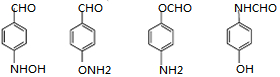 ;
;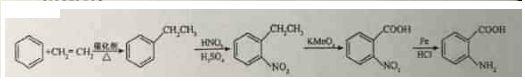 .
.查看答案和解析>>
科目: 来源: 题型:选择题
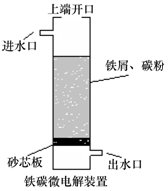 铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-3e-=Fe3+ | |
| B. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| C. | 不鼓入空气时,正极的电极反应式为H++e-=H• | |
| D. | 处理含有C2O42-的污水时,上端开口应关闭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com