
科目: 来源: 题型:选择题
| A. | Sr为于第4周期ⅡA 族 | |
| B. | ${\;}_{38}^{90}$Sr核内中子数与质子数之差为14 | |
| C. | ${\;}_{38}^{90}$Sr与${\;}_{39}^{90}$Y互为同位素 | |
| D. | ${\;}_{38}^{90}$Sr的核内质子数为38,Sr元素的相对原子质量为90 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 都能够在空气中剧烈燃烧 | |
| B. | 都能够与水反应生成碱和H2 | |
| C. | 都可以保存在煤油中 | |
| D. | 都是密度比较小、熔点比较低的金属 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,7.8 gNa2O2含有的Na+数为0.2NA | |
| B. | 标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA | |
| C. | 标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L | |
| D. | 50℃、1×105Pa下6g NO2与0℃、2×105 Pa下46 g N2O4均含有3NA个原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 1 L 0.1 mol•L-1 (NH4)2Fe(SO4)2的溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 NaHCO3溶液中:c(H+)+c(H2CO3)═c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | CH3COOH+OH-?CH3COO-+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电负性:④>③>②>① | B. | 原子半径:④>③>②>① | ||
| C. | 第一电离能:④>③>②>① | D. | 最高正化合价:④>③>②>① |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
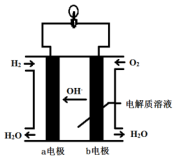 英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.
英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com