
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgCl是氧化产物 | |
| B. | 每生产1mol Na2Mn5O10转移3mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 正极反应式:Ag+Cl--e-═AgCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| D. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中大量存在Na+、NH4+、SiO32-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液中可能大量存在Na+、H+、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
查看答案和解析>>
科目: 来源: 题型:解答题
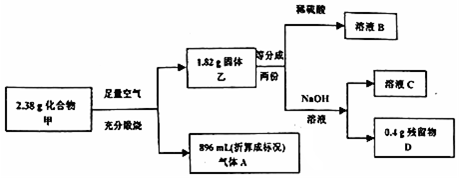
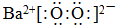 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验淀粉是否水解 | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热沸腾 |
| D | 证明SO2有漂白性 | 将SO2通入酸性高锰酸钾溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 面粉生产车间应严禁烟火 | |
| B. | NH3泄露时向空中喷洒水雾 | |
| C. | 含Cl2的尾气用碱溶液处理后再排放 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上述热化学方程式说明反应物的总键能大于生成物的总键能 | |
| B. | 达平衡后再通入NH3,则平衡正向移动,NH3转化率减小 | |
| C. | 达平衡后升温,则逆反应速率加快,正反应速率减慢,平衡逆向移动 | |
| D. | 达平衡后加入催化剂能同时增大正逆反应速率,平衡发生移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com