
科目: 来源: 题型:填空题
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
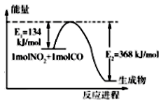 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
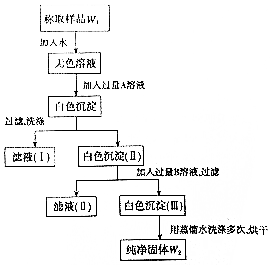 实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.
实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目: 来源: 题型:实验题
 (1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.| 滴定次数 | 待测液体积(mL)[来源 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目: 来源: 题型:填空题
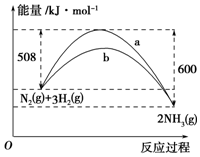 如图是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为N2(s)+3H2(g)?2NH3(g)△H=-92 kJ/mola、b两条曲线产生区别的原因很可能是a不适用催化剂,b使用了催化剂.
如图是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为N2(s)+3H2(g)?2NH3(g)△H=-92 kJ/mola、b两条曲线产生区别的原因很可能是a不适用催化剂,b使用了催化剂.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com