
科目: 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
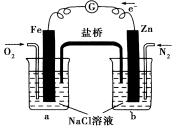
| A. | 烧杯b中发生还原反应 | |
| B. | 烧杯b中发生的反应为2Cl--2e-═Cl2↑ | |
| C. | 烧杯a中发生的反应为2H++2e-═H2↑ | |
| D. | 烧杯a中的溶液pH升高 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
| t/s | 0 | 30 | 150 | 250 | 350 | 450 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应;再向反应液中滴加酚酞 | 产生气体,气体可燃,溶液变浅红色 |
| ②向新制得Na2S饱和溶液中滴加新制氯水 | 生成淡黄色沉淀 |
| ③钠与滴有酚酞试液的冷水反应 | 浮于水面上,熔成小球,四处游动,逐渐缩小,溶液变红色 |
| ④镁带与2mol/L的盐酸反应 | 剧烈反应,产生的气体可燃 |
| ⑤铝条与2mol/L的盐酸反应 | 反应不十分剧烈;产生的气体可燃 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | 先生成白色絮状沉淀,最后沉淀全部溶解 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| ① | 不填 | 不填 |
| ② | S2-+Cl2=S↓+2Cl- | |
| ③ | 不填 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ④ | 不填 | 不填 |
| ⑤ | 不填 | 2Al+6H+=2Al3++3H2↑ |
| ⑥ | 先生成白色絮状沉淀,最后沉淀全部溶解 | Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便 | |
| B. | 新型无机非金属材料具有光学特性、生物功能、电学特性、耐高温、强度高 | |
| C. | 高温结构陶瓷比金属材料具有许多优点,如耐高温不怕氧化、密度小等优点 | |
| D. | 光导纤维除用于通信外,还可以用于医疗、信息处理等许多方面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com