
科目: 来源: 题型:解答题
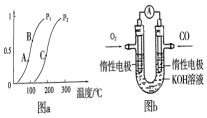 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目: 来源: 题型:解答题
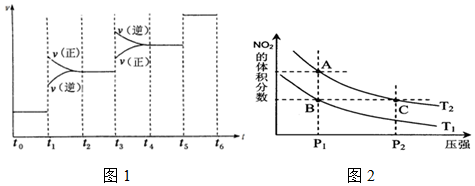
 (1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
(1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
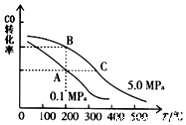 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.查看答案和解析>>
科目: 来源: 题型:解答题
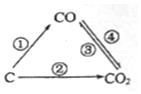 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目: 来源: 题型:填空题
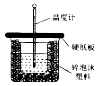 (1)在一定条件下N2与H2反应生成NH3,请回答:
(1)在一定条件下N2与H2反应生成NH3,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com