
科目: 来源: 题型:选择题
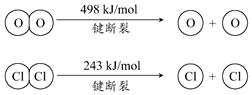 用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:
用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:| A. | 升高温度能提高HCl的转化率 | |
| B. | 加入催化剂,能使该反运的焓变减小 | |
| C. | 1molCl2转化为2molCl原子放出243kJ热量 | |
| D. | 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高 |
查看答案和解析>>
科目: 来源: 题型:推断题
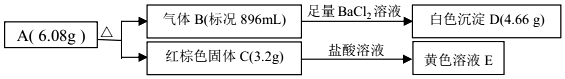
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 33.8 |
| ② | 24.7 | 33.7 |
| ③ | 24.9 | 35.9 |
查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解饱和食盐水制得Cl2 | B. | 电解熔融MgCl2制得金属Mg | ||
| C. | 高温下CO还原赤铁矿可用于炼铁 | D. | 电解熔融AlCl3制得金属Al |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
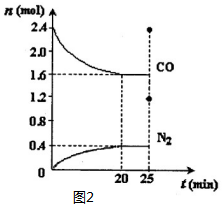 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com