
科目: 来源: 题型:选择题
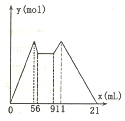 如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质
如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质| A. | 原混合液中,c(A13+):c(Mg2+):c(C1)=1:1:5 | |
| B. | 若A和B为一元强碱和一元强酸,则滴加7.5mL剂A后改滴试剂B | |
| C. | 若A是NaOH,B是盐酸,则c(NaOH):c(HC1)=2:1 | |
| D. | 从6到9,相应离子反应方程式H++OH-═H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硒(Se)化氢比硫化氢稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②⑦ | B. | ③④⑤⑥⑦ | C. | ③⑤ | D. | ③④⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
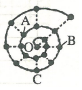 小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 | |
| B. | 离O点越远的元素原子半径一定越大 | |
| C. | B、C最高价氧化物的水化物可以相互反应 | |
| D. | B元素是图中金属性最强的元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向稀硝酸中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O=[AI(OH)4]-+4NH4+ | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 向稀硝酸中加入少量铁粉 | 有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状物质 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁红的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
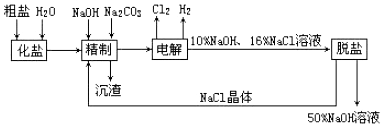
查看答案和解析>>
科目: 来源: 题型:解答题
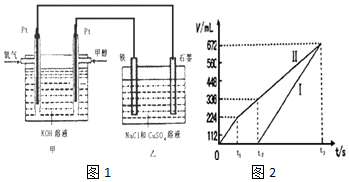
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com