
科目: 来源: 题型:选择题
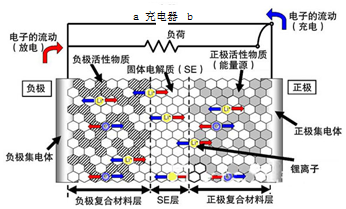 新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )| A. | 电池放电时,负极发生的反应为:nC+xLi++xe-═LixCn | |
| B. | 充电器的a端接电源的负极,b端接电源的正极 | |
| C. | 电池充电时Li+自左向右移动 | |
| D. | 电池工作时,固体电解质因熔融而导电 |
查看答案和解析>>
科目: 来源: 题型:实验题
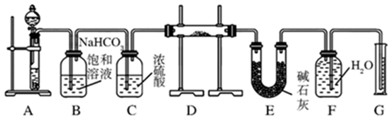
查看答案和解析>>
科目: 来源: 题型:解答题
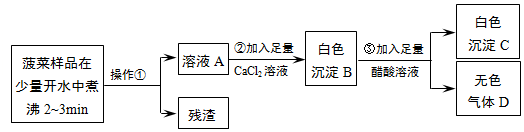
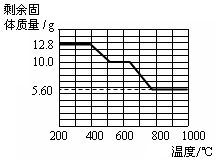
查看答案和解析>>
科目: 来源: 题型:解答题
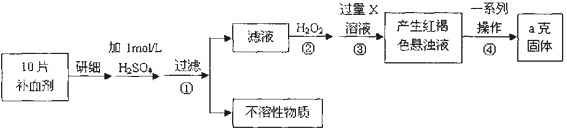
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:实验题
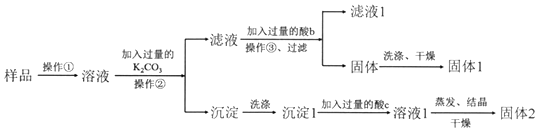
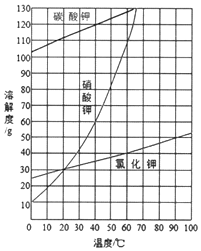
查看答案和解析>>
科目: 来源: 题型:实验题
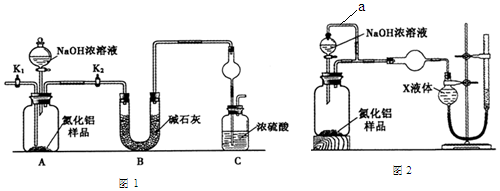
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 地壳中含量最多的元素 |
| Y | 元素的气态氢化物极易溶于水,水溶液遇酚酞变红 |
| Z | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒剂 |
| W | 与Z同周期,第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| R | 有多种化合价,水溶液中其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
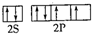 ,Z的基态原子的电子排布式为1s22s22p63s23p5.
,Z的基态原子的电子排布式为1s22s22p63s23p5.| 简单离子半径 | 第一电离能 | 电负性 | 气态氢化物稳定性 |
| X<Y | X<Y | X>Z | H2X>YH3 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 滴定序号[来源:学科网] | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com