
科目: 来源: 题型:选择题
| A. | 混合气体的压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的颜色不再变化 | D. | 混合气体中c(H2):c(I2):c(HI)=1:1:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时,正极电极反应是 Pb(s)+SO42-(aq)═PbSO4(s)+2e- | |
| B. | 放电时,电池的负极材料是铅板,负极质量增加 | |
| C. | 充电时,电池中硫酸的浓度始终保持不变 | |
| D. | 充电时,阳极发生的反应是 PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不含OH-的溶液 | B. | 使酚酞试剂呈无色的溶液 | ||
| C. | pH=7的溶液 | D. | c(H+)=$\sqrt{{K}_{w}}$的溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| B. | 手机外壳上贴的碳纤维外膜是一种新型无机非金属材料 | |
| C. | 用淀粉溶液可以直接检验海水中是否含碘元素 | |
| D. | 明矾净水的原理和“84”消毒液消毒的原理相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
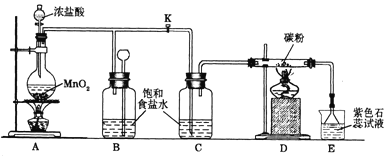
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硫酸有脱水性,故可用做干燥剂 | |
| B. | 浓硫酸有强酸性,故能与金属活动顺序氢后的金属反应 | |
| C. | 硫酸的酸性比盐酸强,利用复分解反应用硫酸可以制盐酸 | |
| D. | 由于浓硫酸具强氧化性,因此不能干燥硫化氢和碘化氢气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨气通入稀硫酸 NH3+H+═NH4+ | |
| B. | 稀烧碱溶液和氯化铵溶液混合 NH4++OH-═NH3•H2O | |
| C. | 碳酸氢铵和足量浓烧碱溶液混合加热 NH4++OH-═NH3↑+H2O | |
| D. | Cl2和水反应 Cl2+H2O═H++Cl-+HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铵盐都易溶于水 | |
| B. | 铵盐受热分解都能得到氨气 | |
| C. | 除去NH4Cl溶液中少量的CaCl2,加过量的NH4HCO3溶液后过滤 | |
| D. | 铵盐与碱液共热都能生成使蓝色石蕊试变红的气体 |
查看答案和解析>>
科目: 来源: 题型:实验题
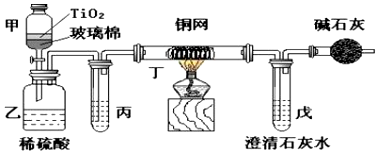
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com