
科目: 来源: 题型:实验题
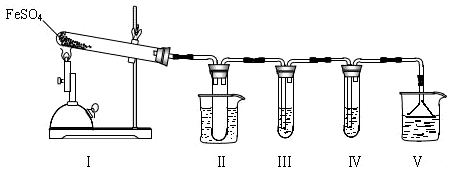
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5 mol•L -1 BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01 mol•L-1 酸性 KMnO4 溶液(或0.0l mol•L-1 溴水). | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |

查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
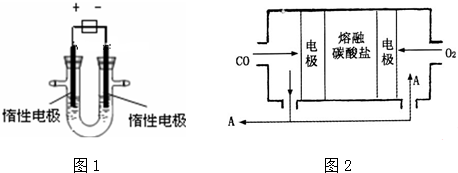
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

 ,E
,E .
. ;②CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;⑥
;②CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;⑥ .H→I
.H→I $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目: 来源: 题型:解答题
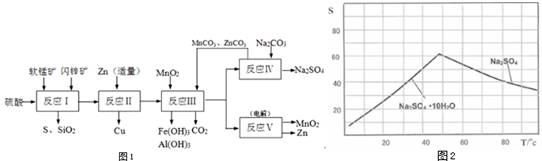
查看答案和解析>>
科目: 来源: 题型:选择题
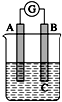 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A. | A是Zn,B是Cu,C为稀硫酸 | B. | A是Cu,B是Zn,C为稀硫酸 | ||
| C. | A是Fe,B是Ag,C为稀AgNO3溶液 | D. | A是Ag,B是Fe,C为稀AgNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
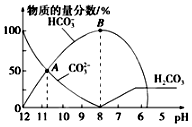 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )| A. | A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 随着盐酸的加入,溶液中$\frac{c(HC{O}_{3}^{-})c(O{H}^{-})}{c(C{O}_{3}^{2-})}$将减小 | |
| C. | 随着盐酸的加入,当pH约为6时,溶液中开始放出气体 | |
| D. | 当溶液的pH为7时,溶液的总体积为40mL |
查看答案和解析>>
科目: 来源: 题型:推断题
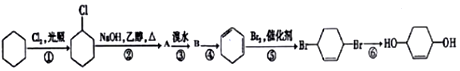
 ,B的结构简式是
,B的结构简式是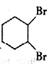 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
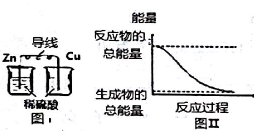
| A. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| B. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图Ⅱ所示的反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com