
科目: 来源: 题型:解答题
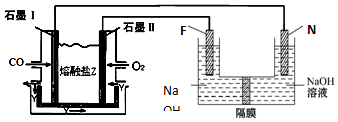
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H5OH+3O2=2CO2+3H2O△H=-1367.0 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3 kmol-1 | |
| C. | S(s)+O2(g)=SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO(g)+O2(g)=2NO2(g)△H=-116.2 kJ |
查看答案和解析>>
科目: 来源: 题型:实验题
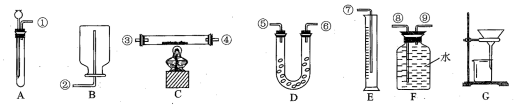
查看答案和解析>>
科目: 来源: 题型:实验题
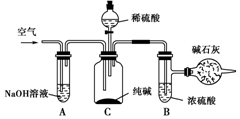 工业纯碱中常含有NaCl、Na2SO4等杂质,可用如图所示的装置测定工业纯碱中有效成分的含量.
工业纯碱中常含有NaCl、Na2SO4等杂质,可用如图所示的装置测定工业纯碱中有效成分的含量.查看答案和解析>>
科目: 来源: 题型:实验题
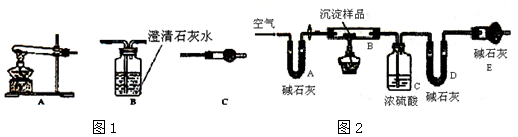
查看答案和解析>>
科目: 来源: 题型:实验题
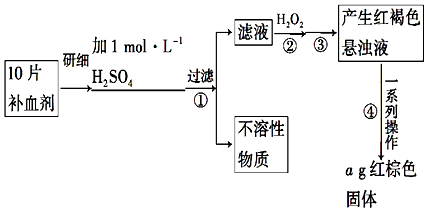
查看答案和解析>>
科目: 来源: 题型:解答题
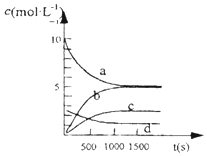 (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(ml) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com