
科目: 来源: 题型:解答题
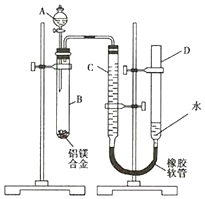 某学习小组用如图装置测定镁铝合金中铝的质量分数.
某学习小组用如图装置测定镁铝合金中铝的质量分数.查看答案和解析>>
科目: 来源: 题型:解答题
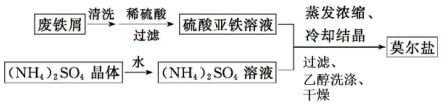
查看答案和解析>>
科目: 来源: 题型:实验题
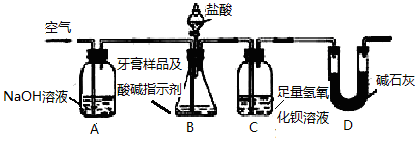
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 各电子层的电子数 | |||
| K | L | M | N | |
| A | 2 | 7 | ||
| B | 2 | 8 | 1 | |
| C | 2 | 8 | 18 | 7 |
| D | 2 | 8 | 2 | |
| E | 2 | 8 | 7 | |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
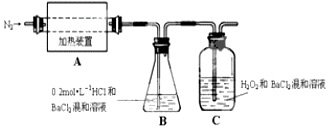
查看答案和解析>>
科目: 来源: 题型:解答题
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目: 来源: 题型:解答题
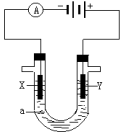 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com