
科目: 来源: 题型:填空题
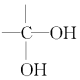 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$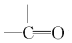
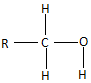 $\stackrel{2H}{→}$
$\stackrel{2H}{→}$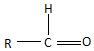 ,失去的氢原子再和氧原子结合成水分子
,失去的氢原子再和氧原子结合成水分子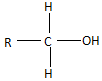 +$\stackrel{O_{2}}{→}$
+$\stackrel{O_{2}}{→}$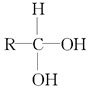 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$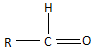 反应过程中为先加氧后脱水
反应过程中为先加氧后脱水查看答案和解析>>
科目: 来源: 题型:填空题
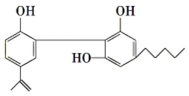 运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图.
运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
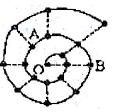 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | A、B组成的化合物中不可能含有共价键 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | 离O点越远的元素原子半径越大 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
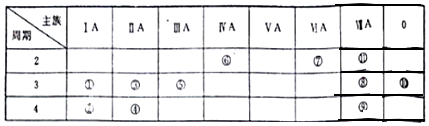
| A. | 原子半径:W>X>Y | |
| B. | X的单质不能与Z的氧化物反应 | |
| C. | W的单质在Y的单质中燃烧产生淡蓝色火焰 | |
| D. | X、Y可形成既有离子键又有共价键的离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
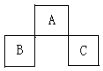 A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )| A. | Be、Na、Al | B. | O、P、Cl | C. | P、O、Cl | D. | C、Al、P |
查看答案和解析>>
科目: 来源: 题型:解答题
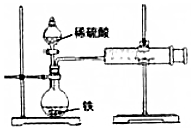 某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.
某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.查看答案和解析>>
科目: 来源: 题型:解答题
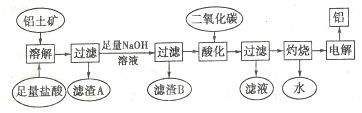
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Y>Z | |
| B. | X元素的一种单质可用于消毒杀菌 | |
| C. | Y的单质在空气中放置表面易生成一层致密的氧化膜 | |
| D. | Z的单质在氧气中点燃可生成两种酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com