
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al(OH)3$\stackrel{电解}{→}$ Al$→_{高温}^{Fe_{2}O_{3}}$ Fe | |
| B. | S$\stackrel{O_{2}/点燃}{→}$ SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| C. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$ Cu | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$ FeCl3(aq)$\stackrel{△}{→}$ 无水FeCl3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2-丙醇 | B. | 2-丁醇 | C. | 1-戊醇 | D. | 2-甲基-2-丙醇 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 定容时俯视刻度线,会使所配溶液浓度偏大 | |
| B. | 将4.0gNaOH固体溶于1L水中可配成0.1mol/L的NaOH溶液 | |
| C. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水到刻度线 | |
| D. | 称量时,将固体NaOH放在垫有纸的托盘天平左盘上 |
查看答案和解析>>
科目: 来源: 题型:解答题
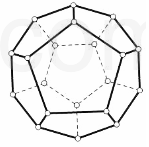 2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.
2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.查看答案和解析>>
科目: 来源: 题型:解答题
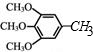 )是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下:
)是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下: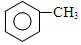 $\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$
$\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$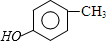 $→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$
$→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$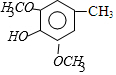 $\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
$\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
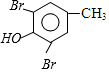 ,C的结构简式为
,C的结构简式为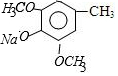 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目: 来源: 题型:实验题
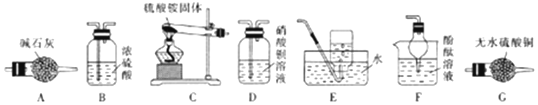
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com