
科目: 来源: 题型:选择题
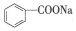 ,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )| A. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| B. | 提高CO2充气压力,饮料中c(A-)不变 | |
| C. | 当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甘油作护肤保湿剂是因为甘油有还原性 | |
| B. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
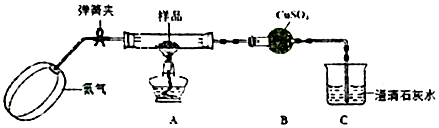
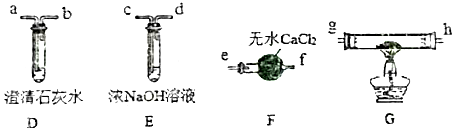
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 古有“靑蒿一握,以水二升漬,绞取汁”,今用乙醚从黄花蒿中提取靑蒿素是利用氧化还原反应原理 | |
| C. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| D. | 纤维素作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |
查看答案和解析>>
科目: 来源: 题型:推断题
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C15H22O5 | B. | C15H20O5 | C. | C15H18O5 | D. | C15H24O5 |
查看答案和解析>>
科目: 来源: 题型:实验题
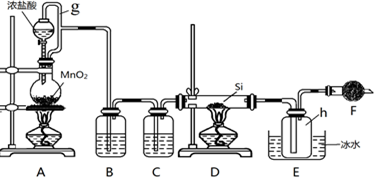
查看答案和解析>>
科目: 来源: 题型:实验题
 有机物 A 是一种纯净的无色黏稠液体,易溶于水.为研究 A 的组成与结构,进行了如下实验,实验步骤:
有机物 A 是一种纯净的无色黏稠液体,易溶于水.为研究 A 的组成与结构,进行了如下实验,实验步骤: .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com