
科目: 来源: 题型:解答题
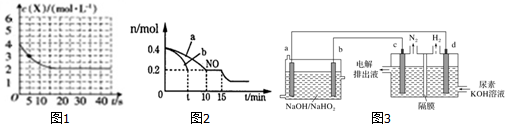
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为了给人类一个美好蓝天,化工企业推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2 | |
| B. | “PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 实验场所严禁携带食物;禁止用饮料瓶装化学药品,防止误食 | |
| D. | 西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,双氧水、“84”消毒液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 3 | t2 |

查看答案和解析>>
科目: 来源: 题型:解答题
 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.查看答案和解析>>
科目: 来源: 题型:选择题
| 实验内容 | 实验现象 | 相关解释 | |
| A | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
| B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
| C | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
| D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | NO2有助燃性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中由水电离出的c(OH-)=10a-14 | |
| B. | 加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$减小 | |
| C. | 该温度下,pH=a的NaOH溶液的物质的量浓度小于0.1mol•L-1 | |
| D. | 加入等浓度、等体积的CH3COOH溶液,所得溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在0.1 mol?L-1的氨水中滴加0.1 mol?L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol?L-1 | |
| C. | 将c mol?L-1的醋酸溶液与0.02 mol?L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{{2×1{0^{-9}}}}{c-0.02}$ | |
| D. | 将0.2 mol•L-1盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序: c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 治疗疟疾的青蒿素(如图),分子式为C15H20O5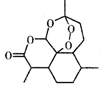 | |
| B. | 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种 | |
| C. | 对三联苯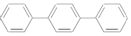 分子中至少有16个原子共平面 分子中至少有16个原子共平面 | |
| D. | 油脂和乙烯在一定条件下都能与水反应,且反应类型相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| B. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、海水晒盐、燃煤烟气的脱硫、从菜籽中提取菜籽油等过程都是物理变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO${\;}_{4}^{2-}$ | |
| B. | c(NaHCO3)=0.1 mol•L-1的溶液中:K+、C6H5O-、SO${\;}_{4}^{2-}$、CO32- | |
| C. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63? | |
| D. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com