
科目: 来源: 题型:多选题
| A. | 该反应中反应物的总能量大于生成物的总能量 | |
| B. | 该反应中反应物的总能量小于生成物的总能量 | |
| C. | 该反应发生时,一定不需要加热 | |
| D. | 如果该反应开始后停止加热,反应一定能继续进行 |
查看答案和解析>>
科目: 来源: 题型:解答题
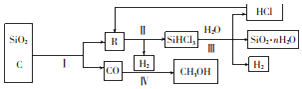
查看答案和解析>>
科目: 来源: 题型:解答题
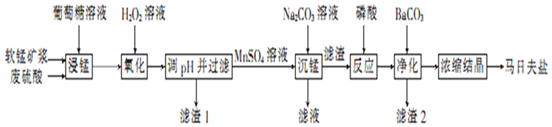
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:实验题

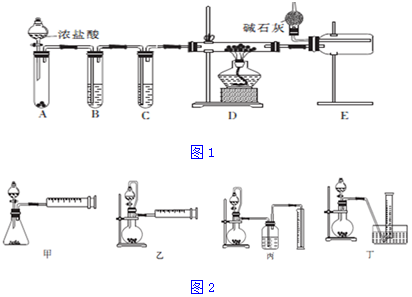
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cn(H2O)m | B. | (C2O3)n(H2O)m | C. | (C2H)n(H2O)m | D. | (CO)n(H2O)m |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | IVA族元素氢化物沸点顺序是GeH4>SiH4>CH4,则VA族元素氢化物沸点顺序也是AsH3>PH3>NH3 | |
| B. | 常见的氢化物是分子晶体,则所有氧化物都是分子晶体 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| D. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④⑥ | C. | ①②⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
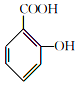 +
+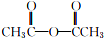 $→_{75-80℃}^{H_{3}PO_{4}}$
$→_{75-80℃}^{H_{3}PO_{4}}$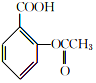 +CH3COOH
+CH3COOH| 名称 | 式量 | 性质 | 熔点/℃ | 沸点/℃ | 溶解度 | ||
| 水 | 乙醇 | 乙酸乙酯 | |||||
| 水杨酸 | 138 | 白色结晶粉末、无臭 | 157~159 | 211 | 溶 | 易溶 | 易溶 |
| 醋酸酐 | 102 | 无色液体、易燃、有醋酸味 | -73.1 | 138.6 | 易溶 | 溶 | 易溶 |
| 乙酸水杨酸 | 180 | 白色针状结晶 | 135 | 321.4 | 冰水微溶、热水可溶 | 易溶 | 微溶 |
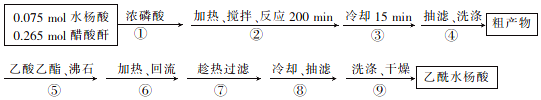
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com