
科目: 来源: 题型:多选题
| 操作及现象 | 结论 | |
| A | 向PbSO4悬浊液中加入KI溶液时出现黄色沉淀 | Ksp(PbI2)<Ksp(PbSO4) |
| B | 向某溶液中滴加氯水后再加入稀C6H5OH溶液,溶液呈红色 | 原溶液中可能含有Fe2+ |
| C | 向Na2SiO3溶液中通入过量SO2气体 | 反应为:SiO${\;}_{3}^{2-}$+SO2+H2O=H2SiO3↓+SO${\;}_{3}^{2-}$ |
| D | 将氢气还原氧化铜所得的红色固体加入足量稀硝酸中,溶液变为蓝色 | 反应为:3Cu+2NO${\;}_{3}^{-}$+8H+=3Cu2++2NO↑+4H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | 只有① |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原料来源广 | B. | 易燃烧,放出热量多 | ||
| C. | 产物无污染 | D. | 制取H2简单易行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生成0.1NA根共价键 | B. | 消耗反应物总体积2.24L | ||
| C. | 转移了2NA个电子 | D. | 产物溶于水后,溶液pH=1 |
查看答案和解析>>
科目: 来源: 题型:填空题
 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 .
. ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 .
.查看答案和解析>>
科目: 来源: 题型:推断题
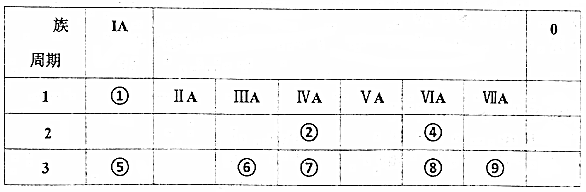
 ;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:
;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
.查看答案和解析>>
科目: 来源: 题型:解答题
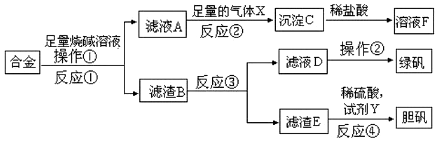
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com