
科目: 来源: 题型:解答题
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有2个羧基 | B. | 含有1个甲基 | ||
| C. | 含有2个羟基 | D. | 同时含有1个羟基和1个醛基 |
查看答案和解析>>
科目: 来源: 题型:解答题
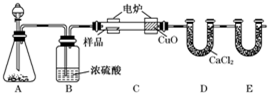
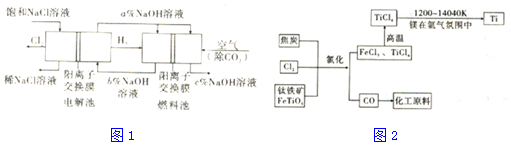
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,得到标准状况下22.4L氢气时,理论上铅蓄电池中消耗氢离子数目为4NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l) | B. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l) | ||
| C. | 2H2(g)+O2(g)═2H2O(l) | D. | 2FeCl3(aq)+Fe(s)═3FeCl3(aq) |
查看答案和解析>>
科目: 来源: 题型:解答题
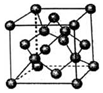 五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题:
五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
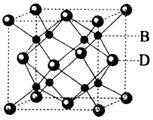 有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:
有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
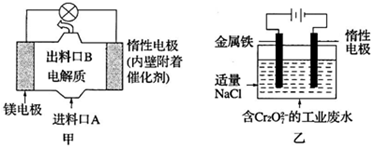
| A. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ | |
| C. | 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生 | |
| D. | 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.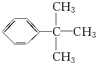 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com