
科目: 来源: 题型:解答题
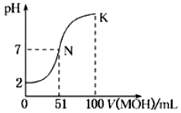
查看答案和解析>>
科目: 来源: 题型:选择题
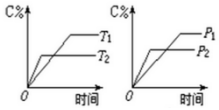 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,若升温,则K减小 | |
| B. | 达平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,若增加A的量,B的转化率增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素符号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
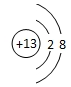 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | m、n | B. | 3、7 | C. | m-2、10-n | D. | m+2、n+10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | |||
| W | Y | Z |
| A. | X、Y和氢三种元素形成的化合物中可能既有离子键、又有共价键 | |
| B. | Y的氧化物的通入过量BaCl2溶液中一定会产生白色沉淀 | |
| C. | W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4 | |
| D. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 |
查看答案和解析>>
科目: 来源: 题型:解答题
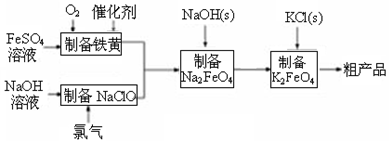
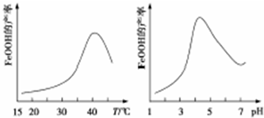
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 L 0.1 mol/L NH4NO3溶液中含有铵根离子数目为0.1NA | |
| B. | 标准状况下,22.4 L SO3中含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L氯气与含有1 mol FeI2的溶液反应时,转移的电子数为2NA | |
| D. | 常温常压下,16g O2作氧化剂时转移电子数一定为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
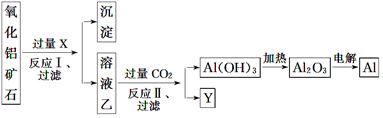
查看答案和解析>>
科目: 来源: 题型:解答题

 ;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com