
科目: 来源: 题型:选择题
| A. | 氯化铝溶液蒸干后灼烧得不到无水氯化铝 | |
| B. | 氯化铁溶液常用作制印刷电路板的腐蚀剂 | |
| C. | 常用热的纯碱溶液除去油污 | |
| D. | 长期施用硫酸铵易使土壤酸化 |
查看答案和解析>>
科目: 来源: 题型:选择题
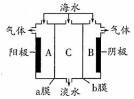 海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如图所示.下列说法正确的是( )
海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如图所示.下列说法正确的是( )| A. | b膜是阳离子交换膜 | |
| B. | A极室产生气泡并伴有少量沉淀生成 | |
| C. | 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC | |
| D. | B极室产生的气体可使湿润的KI淀粉试纸变蓝 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:r(N)>r(M)>r(Y)>r(X) | |
| B. | X与Y形成的化合物溶于水,溶液显碱性 | |
| C. | 简单气态氢化物的热稳定性:M>N>X | |
| D. | 单质的熔点:Y>N>M>X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用CO2合成可降解塑料聚碳酸酯,实现“碳”的循环利用 | |
| B. | 由地沟油加工合成的“生物柴油”与柴油成分相同 | |
| C. | 高温消毒就是用加热的方法使蛋白质变性 | |
| D. | 海水提镁、炼铁、制造玻璃等工业都用到石灰石 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、[Al(OH)4]- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24 L C12与足量铁粉反应转移的电子数为0.2NA | |
| B. | 2 L 0.1 mol•L-1Na2CO3溶液中所含CO32-的数目为0.2NA | |
| C. | 28 g C2H4所含共用电子对数目为4NA | |
| D. | 1 mol H2O中所含的中子数为10NA |
查看答案和解析>>
科目: 来源: 题型:解答题
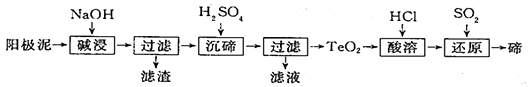
查看答案和解析>>
科目: 来源: 题型:选择题
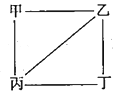 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最小 | |
| D. | W的阴离子可能促进水的电离 |
查看答案和解析>>
科目: 来源: 题型:选择题
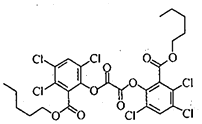 荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光.该草酸二酯的结构简式如图所示.下列有关该草酸二酯的说法不正确的是( )
荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光.该草酸二酯的结构简式如图所示.下列有关该草酸二酯的说法不正确的是( )| A. | 分子中含有一种含氧官能团 | |
| B. | 苯环上的一溴代物只有一种 | |
| C. | 可以发生取代反应和加成反应 | |
| D. | lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com