
科目: 来源: 题型:实验题
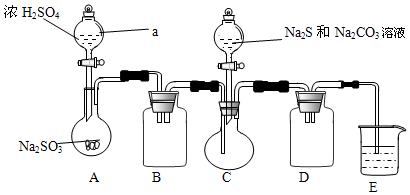
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16 g O2和O3 的混合气体中含有的分子数为0.5 NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数日为1×10-5 NA | |
| C. | 标准状况下,2.24 L Cl2 通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA | |
| D. | 常温下,1 mol的NaHCO3固体中含HCO3-的数目为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 候氏制碱、制取肥皂的工艺过程中均应用了物质溶解度的差异 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “外观如雪,强烧之,紫青烟起”,南北朝陶弘景对硝酸钾的鉴定过程中利用了焰色反应 | |
| D. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 |
查看答案和解析>>
科目: 来源: 题型:解答题
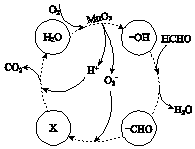 MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
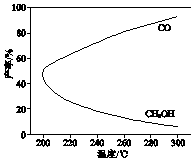 在一定条件下,利用CO2合成CH3OH的反应如下:
在一定条件下,利用CO2合成CH3OH的反应如下:| A. | △H1<0,△H2>0 | |
| B. | 增大压强有利于加快合成反应的速率 | |
| C. | 生产过程中,温度越高越有利于提高CH3OH的产率 | |
| D. | 合成CH3OH反应的平衡常数表达式是K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4 | |
| B. | Na、Mg与水反应,Na更剧烈 | |
| C. | 气态氢化物的稳定性:HF>HCl | |
| D. | 向Na2SO3溶液中加盐酸,有气泡产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
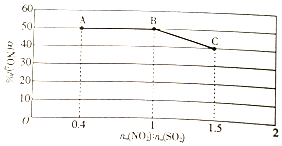 已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).
已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).查看答案和解析>>
科目: 来源: 题型:选择题
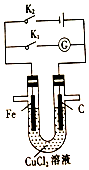
| A. | 同时打开K1、K2,铁棒上有紫红色物质析出 | |
| B. | 只闭合K1,石墨棒上有紫红色物质析出 | |
| C. | 只闭合K2,当电路中通过0.3mol电子时,两极共产生4.48L(标准状况)气体 | |
| D. | 只闭合K2,一段时间后,将电解质溶液搅拌均匀,溶液的pH变大(不考虑Cl2的溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com