
科目: 来源: 题型:实验题
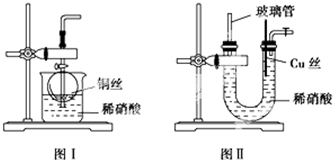
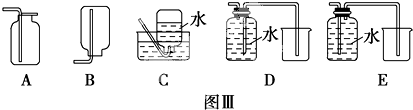
查看答案和解析>>
科目: 来源: 题型:解答题
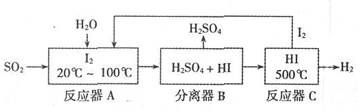
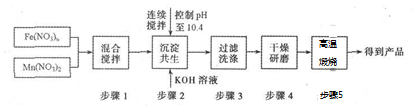
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
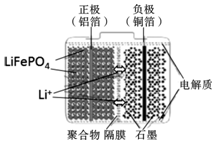 磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )
磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )| A. | 图中聚合物隔膜是阴离子交换膜 | |
| B. | 充电时,Li+迁移方向是“由右向左” | |
| C. | 放电时,正极的电极反应式为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| D. | 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80% |
查看答案和解析>>
科目: 来源: 题型:选择题
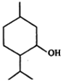
| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用铂丝蘸取溶液X进行焰色反应实验 | 火焰呈黄色 | 溶液X一定是钠盐溶液 |
| B | 将Cl2通入石蕊试液中 | 溶液先变红后褪色 | Cl2具有漂白性 |
| C | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
| D | 向FeBr2溶液中加入少量氯水,再加 CCl4振荡 | CCl4层无色 | Fe2+的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:C>D>B>A | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 最简单气态氢化物的稳定性:B>A | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱 | |
| B. | 金属Mg失火时不能用泡沫灭火器扑灭 | |
| C. | 土壤胶粒带负电荷,有利于铵态氮肥的吸收 | |
| D. | 水玻璃可用于生产黏合剂和防火剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1mol•L-1(NH4)2SO4溶液与0.2mol•L-1NH4Cl溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.21NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com