
科目: 来源: 题型:选择题
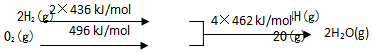
| A. | C(s)的燃烧热110 kJ/mol | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H1=+480 kJ/mol | |
| C. | C(s)+H2O(g)═CO(g)+H2(g)△H1=+130 kJ/mol | |
| D. | 欲分解2 mol H2O(l),至少需要提供4×462 kJ 的热量 |
查看答案和解析>>
科目: 来源: 题型:实验题
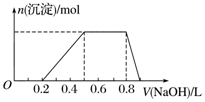
查看答案和解析>>
科目: 来源: 题型:选择题
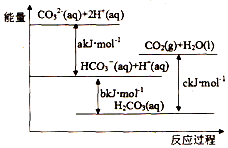
| A. | H2CO3(aq)=CO2(g)+H2O(l)为放热反应 | |
| B. | CO32-(aq)+H+(aq)=HCO3-(aq)△H=akJ/mol | |
| C. | HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)△H=(c-b)kJ/mol | |
| D. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(a+b-c)kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定存在SO42-、SO32-、NH4+,可能存在Na+ | |
| B. | 一定存在SO42-、SO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 溶液中可能含有Cl-,且Na+浓度至少为0.15mol•L-1 | |
| D. | c(SO42-)=0.1mol•L-1,c(NH4+)<c(SO42-) |
查看答案和解析>>
科目: 来源: 题型:选择题
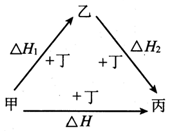 甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )| A. | S、SO3 | B. | AlCl3、NaAlO2 | C. | Na、Na2O2 | D. | NaOH、Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
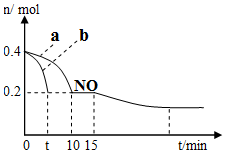 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目: 来源: 题型:选择题
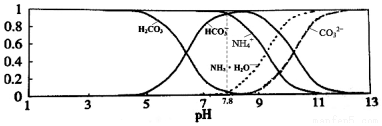
| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | 往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| C. | NH4HCO3溶液中:c(NH4+)+c(NH3•H2O)+c(H+)=c(CO32-)+c(H2CO3)+c(HCO3-)+c(OH-) | |
| D. | 通过分析可知常温下Kb(NH3•H2O)>Ka1(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:解答题
 ).
).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 微电池的负极是Mg | B. | 微电池的负极是Al | ||
| C. | 铝的电极反应式为2H++2e-═H2↑ | D. | 镁的电极反应式为Mg-2e-═Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com