
科目: 来源: 题型:选择题
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有6种 | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
查看答案和解析>>
科目: 来源: 题型:解答题
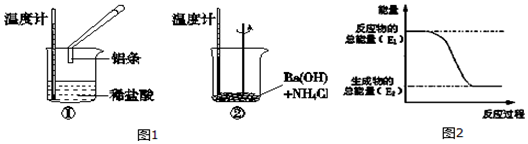

查看答案和解析>>
科目: 来源: 题型:选择题
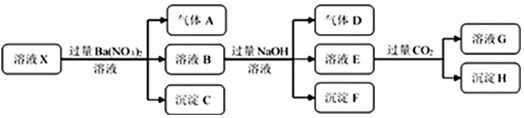
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100mL,产生的气体A为112mL(标况),则X中c(Fe2+)=0.05mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、SO32-、AlO2- | B. | NH4+、Br-、CO32- | ||
| C. | Fe2+、S2-、SO32- | D. | NH4+、Br-、AlO2- |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入 AgNO3溶液,再加入稀 HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入 NaOH 溶液共热,然后加入稀 HNO3使溶液呈酸性,再滴入 AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入 NaOH 溶液共热,冷却后加入 AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:实验题
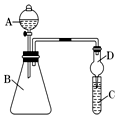 某学习小组同学利用如图装置来验证同主族元素非金属性的变化规律:
某学习小组同学利用如图装置来验证同主族元素非金属性的变化规律:查看答案和解析>>
科目: 来源: 题型:选择题
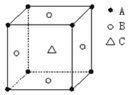 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )| A. | 1:2:1 | B. | 1:3:1 | C. | 2:2:1 | D. | 1:3:3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
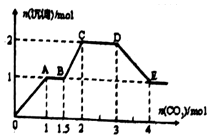 现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是Ba2+、Na+、Cl-、NH4+ | |
| B. | 肯定不存在的离子是Cl-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为:0.2mol/L | |
| D. | OA段反应的离子方程式::2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com