
科目: 来源: 题型:选择题
| A. | 容量瓶用蒸馏水洗净后,未待干燥便用来配制 | |
| B. | NaOH溶解后趁热移入容量瓶中 | |
| C. | 定容时,俯视刻度线 | |
| D. | 摇匀后发现液面未到刻度线,继续加水至刻度线 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤 | 有关问题 |
| (1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为10.6g. |
| (2)称量Na2CO3固体 | 称量过程中主要用到的仪器是托盘天平、砝码、药匙. |
| (3)将Na2CO3加入100mL烧杯中 | 为加快溶解速率,可采取的措施是用玻棒搅拌或加热 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是用玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是当加水璃刻度线1-2cm时改用胶头璃管加水至凹液面与刻度线相切 |
查看答案和解析>>
科目: 来源: 题型:实验题
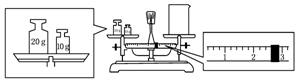
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
 实验室用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com