
科目: 来源: 题型:选择题
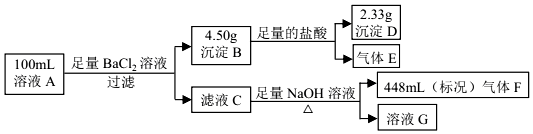
| A. | 溶液 A 中一定存在 NH4+、SO42-、SO32-,可能存在 Na+ | |
| B. | 溶液 A 中一定存在 NH4+、Mg2+、SO42-、SO32-,可能存在 Cl- | |
| C. | 溶液 A 中可能存在 Cl-,且 c(Na+)≥0.20 mol•L-1 | |
| D. | 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+ |
查看答案和解析>>
科目: 来源: 题型:解答题
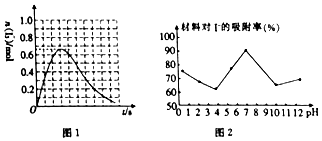
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②④⑦ | C. | ①②⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
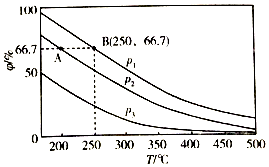 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的最浓度的H2S和NaHS混合溶液中:c(Na)+c(H+)=c(S2-)+c(HS-+c(OH-) | |
| B. | 0.2mol/LNH4C1溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下向20ml0.1mol/LNH4HSO4溶液中滴入同浓度的NaOH溶液至pH=7 c(Na+)>c(SO42-)c(NH4+) | |
| D. | 25℃时,pH=8 的 CH3COONa 稀溶液中,c(CH3COOH)=9.9×10-7mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
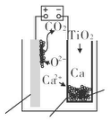 研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2-CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2-CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )| A. | 由 TiO2 制得 1 mol 金属 Ti,理论上外电路通过 2 mol 电子 | |
| B. | 阳极的电极反应式为 C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中 CaO 的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接 Pb 电极 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需NaOH的质量 | 需要NaOH的质量为4.0g |
| (2)称量NaOH固体 | 称量过程中主要用到的仪器是 托盘天平、药匙 |
| (3)将NaOH加入100mL烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是 搅拌、加热、研细氢氧化钠等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com