
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B的物质的量浓度 | D. | 混合气体的平均相对分子质量 |
查看答案和解析>>
科目: 来源: 题型:选择题
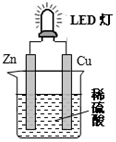
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成橙汁,导线中不会有电子流动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化碳的结构式:O=C=O | B. | HF的电子式: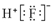 | ||
| C. | Cl-离子的结构示意图: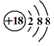 | D. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| X | ||
| Y | ||
| Z |
| A. | Z一定是活泼的金属 | |
| B. | Y的最高化合价为+7价 | |
| C. | Z的最高价氧化物的水化物是强酸 | |
| D. | 1molY单质与足量水反应时,有2mol电子发生转移 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.| a | |||||
| b | |||||
| c | d | e |
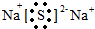 .
.查看答案和解析>>
科目: 来源: 题型:推断题
| A | C | |
| B |
查看答案和解析>>
科目: 来源: 题型:解答题
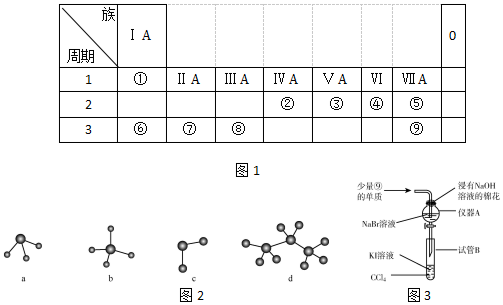
 .
. →
→ ,元素⑥和⑨形成的化合物中含有离子键.
,元素⑥和⑨形成的化合物中含有离子键.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com