
科目: 来源: 题型:实验题
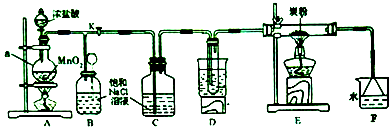
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 合金的性能一般优于纯金属 | |
| B. | 碳素钢是目前用量最大的合金,碳素钢在空气中比纯铁耐腐蚀 | |
| C. | 酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成一层致密的氧化膜 | |
| D. | 用金属铝与V2O5反应冶炼钒,主要是因为铝的还原能力比钒强 |
查看答案和解析>>
科目: 来源: 题型:选择题
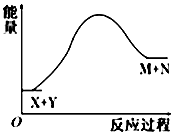
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 试剂 | 乙醚 | 乙醇 | 甲酸 | 甲酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 100.5 | 54.4 |
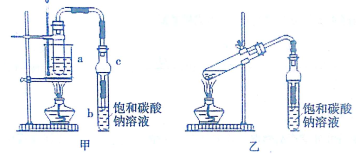
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 92g乙醇与足量的金属钠反应,生成氢气(H2)的分子数为NA | |
| C. | 标准状况下,22.4L已烷中碳碳键数目为5NA | |
| D. | 乙烯和甲醚的混合物共0.1mol,完全燃烧所消耗的氧分子数一定为0.6NA |
查看答案和解析>>
科目: 来源: 题型:实验题
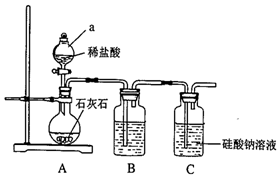 某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:
某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:查看答案和解析>>
科目: 来源: 题型:解答题
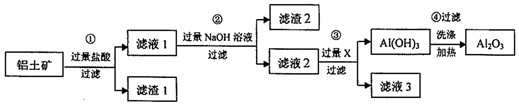
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com