
科目: 来源: 题型:解答题
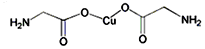
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在0.1mol•L-1的Na2A溶液中,c(A2-)+c(HA-)+2c(Na+)=0.5mol•L-1 | |
| B. | 在0.1mol•L-1的H2A溶液中,c(H+)>0.12mol•L-1 | |
| C. | 将同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,混合溶液可能呈碱性 | |
| D. | 0.1mol•L-1的NaHA溶液中离子浓度为c(Na+)>c(H+)>c(A2-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:实验题
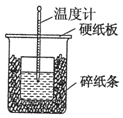 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | C≡O | C=O | C-H | H-H |
| 能量/kJ•mol-1 | 1074 | 803 | 413 | 436 |
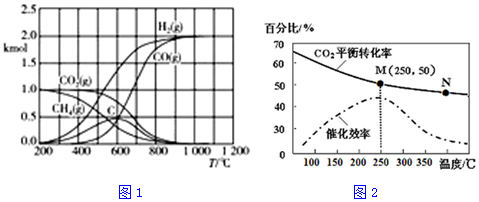
查看答案和解析>>
科目: 来源: 题型:解答题
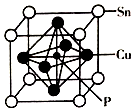 磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.
磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
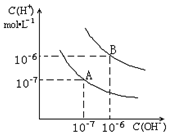 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目: 来源: 题型:推断题
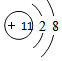 ;
; ,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键).
,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键). ,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.
,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.查看答案和解析>>
科目: 来源: 题型:解答题
 2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.
2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂. (C7H10)是一种重要的高密度液体燃料化学推进剂.已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂.已知:| 燃料 | 密度(g•cm-3) | 体积热值(J•L-1) |
| 降冰片烯 | 1.0 | 4.2×107 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20% | B. | 33% | C. | 50% | D. | 89% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com