
科目: 来源: 题型:选择题
| A. | 硫原子的结构示意图: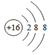 | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | 中子数为7 的碳原子:${\;}_{6}^{7}$C | D. | CO2 的电子式: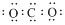 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原则 | |
| B. | 6C的电子排布式1s22s22p${\;}_{x}^{\;}$2违反了洪特规则 | |
| C. | ns电子的能量不一定高于(n-1)p电子的能量 | |
| D. | 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
查看答案和解析>>
科目: 来源: 题型:解答题
 Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.
Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | 饱和CO2溶液中:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| C. | 铝与硫酸铜溶液反应:Al+Cu2+═Al3++Cu | |
| D. | 氯化钡溶液与稀硫酸反应:SO42-+Ba2+═BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 从HF、HCl HBr、HI的酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 | |
| B. | Na在氧气中燃烧主要生成Na2O | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次减弱 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 当电路中通过2mol电子时,阳极可收集到标准状况下气体体积为22.4L |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com