
科目: 来源: 题型:选择题
| A. | 海水淡化的方法有蒸馏法、离子交换法、电渗析法等 | |
| B. | 明矾水解时能生成具有吸附性的胶体粒子,故可用于消毒杀菌 | |
| C. | Ba2+对人体无毒,故BaSO4在医学上可用作“钡餐” | |
| D. | 与铜质水龙头连接处的铜质水管不易发生腐蚀 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | M的分子式为C9H10O4 | |
| B. | M与浓溴水既能发生取代反应,又能发生加成反应 | |
| C. | 一定条件下,1 mol M最多能与3molH2发生反应 | |
| D. | M能分别与Na、NaOH、NaHCO3发生反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| C. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| D. | 铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 22.4LNH3分子中含有3NA个N-H键 | |
| B. | 2.3 g Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA | |
| C. | 1 L0.1 mol•L-1蔗糖溶液中所含分子数为0.1NA | |
| D. | 常温常压下,46g NO2含有的原子数小于3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的电子式为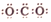 | |
| B. | 浓H2SO4试剂瓶上应贴上危险警告标签 | |
| C. | 根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液 | |
| D. | 核内打8个中子的碳原子可表示为86C |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | HClO的漂白性是因为酸性很弱 | |
| B. | 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大 | |
| C. | 反应 2C1O-+CO2+H2O=CO32-+2HClO可以发生 | |
| D. | 稀释醋酸溶液,则$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$的数值随水量的增加而增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA | |
| D. | 27g铝中加入1mol/L的NaOH溶液,转移电子数是3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等 | |
| B. | 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA | |
| C. | 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA | |
| D. | 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
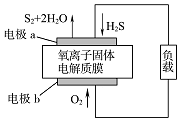 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电路中每流过4 mol电子,正极消耗44.8 L H2S | |
| C. | 电极b上的电极反应为:O2+4e-+4H+═2H2O | |
| D. | 电极a上的电极反应为:2H2S+2O2--4e-═S2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com