
科目: 来源: 题型:实验题
| 溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
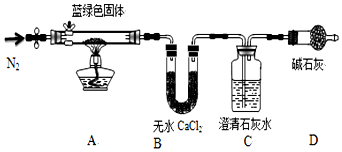
科目: 来源: 题型:实验题
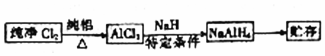
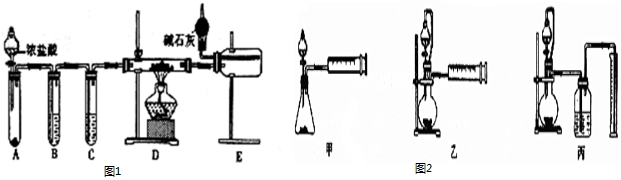
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| B. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| C. | 100mL 1mol/L CH3COONa 溶液中含有的CH3COO-数目为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeCl2有氧化性,能用于雕刻电路板 | |
| B. | 金刚石是自然界中硬度最大的物质,不与氧气发生反应 | |
| C. | 明矾加入水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | SiO2不与强酸反应,可用石英器皿盛装氢氟酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油分馏是物理变化,可获得汽油、煤油、柴油等产品 | |
| B. | C4H9Cl、C4H8Cl2的同分异构体种类分别有4种、9种(不含立体异构) | |
| C. | 淀粉和纤维素水解的最终产物不同 | |
| D. | 由乙酸生成乙酸乙酯属于取代反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
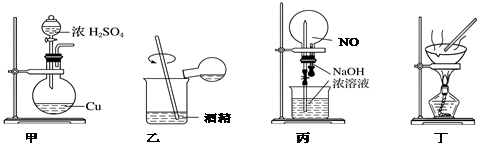
| A. | 用图甲做铜与浓硫酸反应制取SO2 | |
| B. | 用图乙配制浓硫酸与酒精的混合液 | |
| C. | 用图丙做NO与NaOH溶液的“喷泉”实验 | |
| D. | 用装置丁做蒸发CuCl2溶液获得CuCl2•2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100g质量分数为46%的酒精水溶液中的氧原子数为4NA | |
| B. | 500mL 2mol/L碳酸钠溶液中的阴离子数小于NA | |
| C. | 合成氨反应中催化剂降低了反应的活化能,增大了反应的焓变 | |
| D. | 据“△H-T•△S<0”判断某反应能自发,可知该反应一定能发生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 寺院内铜佛像用导线与直流电源的正极连接可以防锈 | |
| B. | 家厨内铁锅洗净后未擦干易生锈主要是发生了化学腐蚀 | |
| C. | 红葡萄酒密封贮存越久越香可能是因为缓慢生成了酯类物质 | |
| D. | 液氯泄漏时,可用肥皂水浸湿的毛巾捂鼻俯卧于低处等待救援 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com