
科目: 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-5 | 6×10-5 | 2×10-4 | 4×10-4 | 3×10-4 | 2×10-4 |
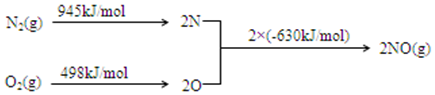
查看答案和解析>>
科目: 来源: 题型:选择题
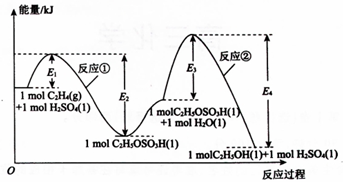 乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是( )
乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是( )| A. | H2SO4是乙烯间接水合法合成乙醇的催化剂 | |
| B. | 缩小容器容积,乙烯的转化率增大 | |
| C. | 反应①和反应②均为放热反应 | |
| D. | 反应②的反应热△H=-(E3-E4)kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
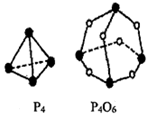 (1)用“=”、“>”、“<”填写下表
(1)用“=”、“>”、“<”填写下表 | 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O <N | Cl <F | NaCl >KBr | HF >HCl |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |
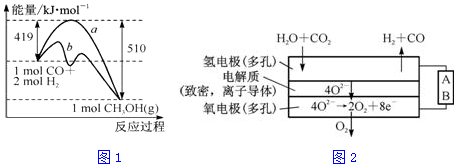
| 离子 | Cu2+ | H+ | Cl- | SO42 - |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
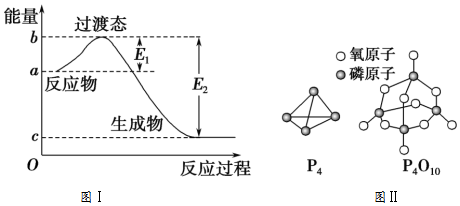
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/(kJ/mol) | a | b | c | x |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com