
科目: 来源: 题型:选择题
| A. | 标准状况下,80gSO3的体积为22.4L | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成28g N2转移的电子数目为3NA | |
| D. | 6.0gSiO2中含有0.1NA个 SiO2分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100 mL 1 mol/L的FeCl3溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1 NA | |
| B. | 7.8 gNa2O2中含有的离子总数目为0.4 NA | |
| C. | 标准状况下,44.8 L HF所含分子数为2 NA | |
| D. | 标准状况下,80 gSO3中所含的原子数为4 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 周期表中的主族中都既有非金属元素又有金属元素 | |
| D. | 原子的最外层电子数相同的元素,一定属于同一族 |
查看答案和解析>>
科目: 来源: 题型:推断题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
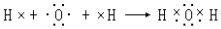 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )
A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )| A. | B 的M层电子数是K层的3倍 | |
| B. | C 的离子具有与 Na+相同的电子层结构 | |
| C. | A 与 D 形成的化合物属于离子化合物 | |
| D. | C 的简单阴离子比 D 的简单阴离子还原性强 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
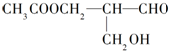 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与新制的氢氧化铜作用 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与H2作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯酚沾在手上应立即用酒精洗涤 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 点燃甲烷、乙烯等可燃性气体前必须先检验其纯度 | |
| D. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:推断题
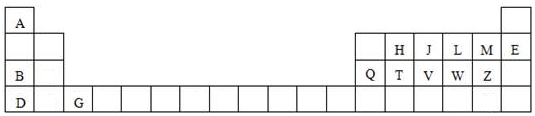
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com