
科目: 来源: 题型:多选题
| 反应时间/min | n(X)/mol | n(Y)/mol |
| 0 | 2.00 | 2.40 |
| 10 | 1.00 | |
| 30 | 0.40 |
| A. | 前10 min内反应的平均速率为v(Z)=0.10 mol•L-1•min-1 | |
| B. | 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应 | |
| C. | 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L | |
| D. | 保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
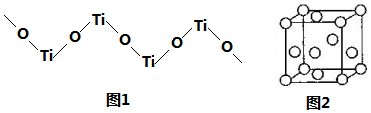
查看答案和解析>>
科目: 来源: 题型:实验题
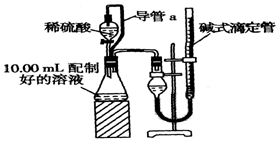 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲学生用电子天平称取NaOH固体1.220g | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生用碱式滴定管取25.0mL0.lmol/L的盐酸 | |
| D. | 丁学生用50mL 量筒量取46.70mL浓盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2与O2反应生成NO | B. | 由NH3转变成 NH4HCO3 | ||
| C. | N2与H2在一定条件下反应生成NH3 | D. | 豆科植物的根瘤吸收氮 |
查看答案和解析>>
科目: 来源: 题型:选择题
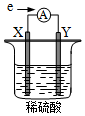 在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )
在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )| A. | 外电路中电流方向为:X→ →Y →Y | |
| B. | 若两电极分别为铁棒和碳棒,则 X 为碳棒,Y 为铁棒 | |
| C. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 | |
| D. | 若两电极都是金属单质,则它们的活动性顺序为 X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com