
科目: 来源: 题型:选择题
| A. | △H1+△H2=△H3 | B. | △H1-△H2=△H3 | C. | △H1+2△H2=△H3 | D. | △H1-2△H2=△H3 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 充电时电极b连接电源的正极 | |
| B. | 放电时右侧电解质储罐中的离子总浓度增大 | |
| C. | 放电时电极a连接粗铜可实现粗铜的精炼 | |
| D. | 充电时阴极反应式为2H++2e-=H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
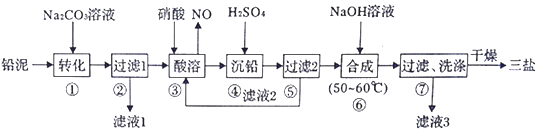
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| B. | AgNO3$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$ Ag | |
| C. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$ Mg |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | V(正)减小,V(逆)增大 | B. | V(正)增大,V(逆)减小 | C. | V(正)、V(逆)都减小 | D. | V(正)、V(逆)都增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应①是铝热反应 | B. | 反应②是置换反应 | C. | C2Cl6属于卤代烃 | D. | 氧化性:Al<Zn<C |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 合成氨工业:温度控制在500℃左右 | |
| B. | 接触法制硫酸:SO2在常压下催化氧化 | |
| C. | 侯氏制碱法:往母液中继续加入食盐和氨气 | |
| D. | 石油化工:将分馏得到的重油在高温下裂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com