
科目: 来源: 题型:解答题
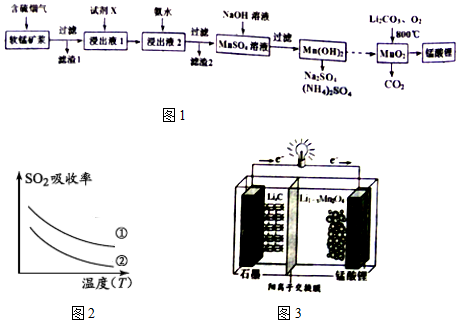
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
| 实验序号 | SO2浓度(g•m-3) | 烟气流速(mL•min-1) |
| ① | 4.1 | 55 |
| ② | 4.1 | 96 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将0.1 mol HCl充分溶解在1 L水中 | |
| B. | 将60 g质量分数为10%的醋酸与940 g水混合 | |
| C. | 将3.1 g氧化钠溶于水并配成1 L溶液 | |
| D. | 将14.2 g Na2SO4•10H2O溶于水中配成1 L溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10min内NaCl浓度变化表示的速率v(NaCl)=0.005 mol•L-1•min-1 | |
| B. | 若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于50% | |
| C. | 若升高温度,平衡逆向移动,则该反应的△H>0 | |
| D. | 若起始时向容器中充入0.2molNO2(g)、0.1molNO(g)和0.1molCl2(g)(固体物质足量),则反应将向正反应方向进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
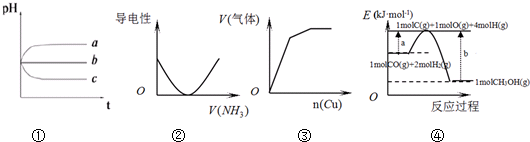
| A. | 图①:pH相同的H2S溶液(a)、稀H2SO4溶液(b)、H2SO3溶液(c)露置于空气中一段时间后,溶液的pH随时间的变化情况 | |
| B. | 图②:表示向乙酸溶液中通入NH3过程中溶液导电性的变化 | |
| C. | 图③:将铜粉加入到一定量浓硝酸中产生的气体与加入铜量的变化情况 | |
| D. | 图④:合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=a-b kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | |
| B. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe2++NO↑+2H2O | |
| C. | Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中性溶液:Cu2+、Fe3+、NO3-、I- | |
| B. | 加入硫氰化钾显血红色的溶液:K+、NH4+、Cl-、NO3- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH-)=1×1012的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,1mol氩气含有的原子数一定为NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液完全反应,转移电子总数为0.1NA | |
| C. | 56g铁片与足量浓硫酸共热反应生成NA个SO2分子 | |
| D. | 常温下,1L pH=12的Na2CO3溶液中含有CO32-的数目大于0.01NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④⑥ | B. | ①④⑥ | C. | ①④ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(H2)=0.05mol/(L•min) | B. | v(N2)=0.03mol/(L•min) | ||
| C. | v(NH3)=0.17g/(L•min) | D. | v(NH3)=0.02mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com